Eile õhtul prof Colin Campbelli uudiskirja saades leidisn sealt kaks artiklit Angelina Jolie vähihirmust ja rindade eemaldamise teaduslikud aspektid. Mõtlesin, et selleks, et inimesed oma päid, jalgu, rindu, peeniseid kiiresti mõne toreda nimega geeni tõttu maha ei lõikaks, võiks olla huvitav lugeda PhD Jane Philpott (Capbelli Fondi instruktor) artiklit:
Jane Philpott MA (Oxon), MSc, PhD


![Microsoft PowerPoint - Presentation1 (3) [Read-Only]](http://drjanephilpott.files.wordpress.com/2013/05/dna-methylation.jpg?w=500&h=352)









Angelina Jolie
Angelina Jolie´l
pidi olema omajagu julgust, et öelda kogu maailmale läbi New York Times
artikli, et on läbinud ennetava ravina mõlema rinna masektoomia (eemaldamine).
A nimekirja näitlejannade üle otsustatakse tavaliselt nii nende
näitlejaoskuse kui ka välimuse järgi.
Angelina tegi oma
valiku, kuna tema arstid hoiatasid teda, et tal on 87% risk rinnavähi arenguks
ja 50% risk saada munasarjavähk. Seda seetõttu, et tema ema suri rinnavähki ja
ta kannab BRCA1 geeni.
Ma aktsepteerin Angelina
otsust, mis tundus talle ja tema perele õige.
See on midagi, mida
me kõik võime teha, kui puutume kokku raskete otsuste ja
süüdistuste/hinnangute tsunami all. Lugu
iseenesest tõstatab teatud küsimuse – kas me tõesti oleme oma geenide
alluvuses.
Kas meie geenid dikteerivad meie saatuse või meie jõud
käib neist üle?
Mina tahaksin teile
rääkida järgmist:

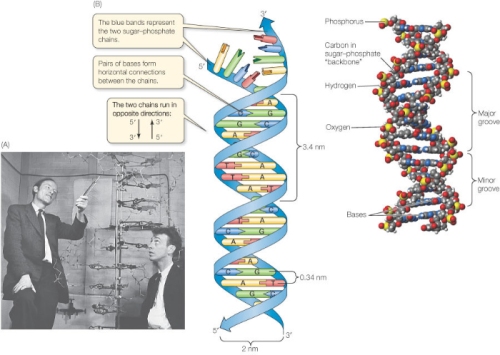
1868 aastal avastas Friedrich Miescher DNA, ja 1953 aastal
avastasid James Watson ja Francis Crick DNA
molekulaarse struktuuri, seda koos Maurice Wilkins, Rosalind Franklin, Erwin
Chargaff ja Linus Pauling abiga.
Järgnevatel
aastatel avastasid teadlased veel palju geneetilisest koodist, mis dikteerib
selle, kes me oleme.
Meie DNA – spetsiifiliselt
võttes 25 000 geeni on identifitseeritud Human Genome Project poolt – praegusel ajal tuntud kui inimkeha tutvustav juhend.
Geeniteadus on
tõmmanud ligi miljardeid dollareid uuringute tarbeks ja seda on välja hõigatud,
kui võtit raskete haiguste (vähk) mõistmises ja ravimises.
Probleemiks on, et
hoolimata kogu sellest hulgast rahast ei ole meie teadmised geneetikas andnud
lubatud revolutsioonilisi ravitulemusi vähi osas.
Viimane ametlik
raport Ameerikas pealkirjaga “War on Cancer” toob välja, et surm kõikidesse
vähiliikidesse kokku aastate 2000-2009 jooksul on vähenenud 1,5% aasta kohta.
See ei ole eriti suurem, kui eelneval 5 aastasel perioodil. Surm teatud
vähiliikidesse nagu maksa, pankrease, emaka, melanoomi kasvab jätkuvalt.
Inimese papilloomiviirus (HPV) – mis on seotud oraalse, anaalse, vaginaalse,
häbeme, peenise ja emakakaela vähiga on jätkuvalt tõrksalt kõrge, seda
hoolimata vaktsiinist.
Sama on
epiteelivähkidega (kartsinoomid) ja sarkoomidega, mis siiani ravimatud.
Rinnavähk hakkas
vähenema umbes 10 aastat tagasi, kui paljud naised lõpetasid hormoonasendusravi
menopausi ajal. Sellest ajast on rinnavähi esinemissagedus jõudnud teatud platooni
ja tõusev on see vähiliik ainult mustanahaliste naiste seas.
Vähi langus on
seostatud suitsetamise vähenemisega [1]. Suitsetamine on põhjustanud
rohkem kui tosinat erinevat vähki sh kopsu, pea, põie ja suu.

Kuigi
paranenud on sõeluuringud ja mõningate vähiliikide ravi, ei ole uued
kallid ravimid pikendanud vähihaige elu rohkem kui keskmiselt 3-4 kuud.
James Watson, kes
on tuntud oma osa poolest DNA struktuuri avastamisel, kirjutab ajakirjas Royal Society Journal “Open
Biology”[2]:
Isegi hoolimata
suures variatsioonis olemasolevate intelligentsete, geenidele suunatud
ravimitest, mida nüüdismeditsiin kasutab, need põhiliselt siiski hoiavad ainult
ajutiselt tagasi surmavat hävitustööd, mida teevad enamiku vähkidest sh kopsu,
jämesoole ja rinnavähk. Need vähid muutuvad ravimist hoolimata metastaatiliseks
ja ületavad kirurgide ja keemia/kiiritus spetsialistide oskused. Ja hoolimata sellest,
et meil on varsti täielik ülevaade sellest, kuidas enamik vähiliike kasvavad ja
funktsioneerivad geneetilisel ja biokeemilisel tasandil, on nende „ravi“
paljude kogenud teadlaste jaoks praegu veel hirmuäratavam, kui see oli 1971
aastal, mil president Nixon algatas „War
on Cancer“.
Vaadates aastakümnete uuringutele, ravi maksumusele,
teadlaste ja ajakirjade arvukusele ning inimestele, kes jätkuvalt surevad, siis
tuleks endalt küsida, kas me ei ole mitte haukunud vale puu all.
Mina usun, et olemegi.
Reaalsuseks on see,
et nii kiiresti, kui teadlased avastavad „maagilise võimaluse“ blokeerida mingi
kindel valk või rakuline reaktsioon, et vähki hävitada, siis vähirakud leivad
tee teraapiast mööda minna, areneda ja vohada.
Kuidas nad seda
teevad?
Tuleb siiski välja, et DNA, genoom, on ainult pool
lugu.
Ei peaks olema
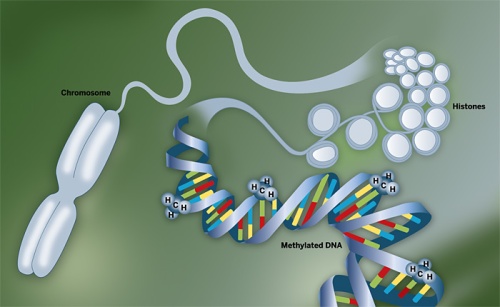
üllatav, et kromosoomid sisaldavad ainult 50% DNA; teine 50% on valk. Igas
kromosoomis on DNA keerdunud valkude ümber, mida nimetatakse histoonideks.
Mõlemad nii DNA kui histoonid on kaetud miljonite väikeste keemiliste
märgistega.
Seda struktuuri
teist kihti histoonide ja kemikaalidega nimetatakse epigenoomiks – mis
sisuliselt tähendab „üle genoomi“.
Epigenoom kujundab
genoomi, DNA füüsilise struktuuri. See pakib tihedalt sisse mitteaktiivsed geenid
ja muudab nad lugematuks. Aktiivsete
geenide ümber on nö pakend lõtv ja võimaldab neile kerget ligipääsu.

Epigenoom
Erinevad geenide asetused on aktiivsed erinevates
rakkudes.
Näiteks, inimese
maksarakk sisaldab sama DNA-d, mida ka ajurakk, ent kuidagi on sel maksaraku
DNA-l teada ainult nende valkude kodeering, mis võimaldavad funktsioneerida
maksal. Vastavad instruktsioonid ei ole leitud mitte DNA-st, vaid kemikaalide
märgistuses epigenoomis. DNA kood jääb
fikseeritud kogu eluks, epigenoom on paindlikum.
Epigenoomi
märgistused reageerivad signaalidele, mis tulevad nii raku sisemisest
keskkonnast, kui ka välisest keskkonnast nagu dieet, stress ja meie mõtted.
Epigenoom korrigeerib spetsiifilisi
geene vastavalt kiiresti muutuval keskkonnale.
Kuidas see töötab?
1980datel aastatel
teadlased avastasid, et vastus sellele küsimusele on peidus spetsiifilistes
keemilistes muutustes, mis on seotud histooni valkudega ja see ei muuda DNAd
üldse.
Millised need
muutused on?
Koolibioloogias me
õpime, et DNA on ehitatud neljast erinevast üksusest, mida nimetatakse
nukleotiidideks: adeniin, tsütosiin, guaniin, and tümiin.
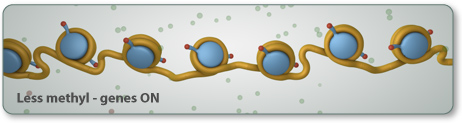
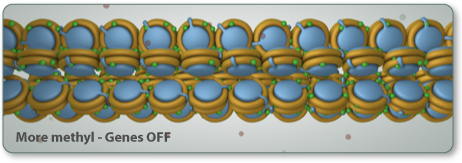
Ühes variandis
epigenoomi muutmisprotsessis metüülgrupp (üks süsiniku aatom seotud kolme
vesiniku aatomiga -CH3) lisandub ensüümide abil spetsiifilisele tsütosiinile
DNAs.
![Microsoft PowerPoint - Presentation1 (3) [Read-Only]](http://drjanephilpott.files.wordpress.com/2013/05/dna-methylation.jpg?w=500&h=352)
See protsess, nimega
DNA metüülimine, on teadaolevalt mängimas võtmerolli mõlemas protsessis - nii
arengus kui haiguses.
DNA metüülimine
mõjutab seda, millise vormi molekul saab ning reguleerib, millised geenid on
vabalt loetavad või tõlgendatavad.
Hiljuti avastati
teist tüüpi epigeneetiline DNA muutumine: hüdroksümetüülrühma (–CH2–OH)
lisandumine DNA tsütosiinile.
Histooni valgud
võivad samuti mitmes variatsioonis muutuda; lisaks metüleerimisele võivad
muutused tekkida koos atsetüülgrupiga (atsetüülimine), fosfaatgrupiga (fosforüülimine),
ubikvitiin valkudega (ubikvitüleerimine) ja SUMO valkudega (sumoylation).
Aga epigeneetilised
nähtused ei piirdu DNA metüülimise ja erinevate histoonide modifikatsioonidega.
Teadalsed on
avastanud, et RNA molekulid ise võivad samuti otseselt DNA-d mõjutada –
blokeerides füüsiliselt DNA segmentide lugemist.
Need RNA molekulid
ei ole klassikalised RNA sõnumikandjad (mRNA) molekulid nagu me neid
koolibioloogias õppinud oleme. Õigemini on need RNA molekulid – nimetustega antisense RNAd, microRNAd ja mittekodeeritavad RNAd – peamiselt tuumas, kus nad
kutsuvad esile muudatused DNA funktsioneerimises.
Siiani ei ole veel
täpselt teada, kuidas need RNA molekulid töötavad, kuid tundub, et nad võivad
seonduda histooni valkudega ja/või aidata välja lülitada geenpromootoreid.
Niisiis, kuidas
keskkond reageerib epigenoomiga, millised mõjutused nendest koostoimetest
mõjutavad meie geene?
Üks kõige erutavamaid avastusi kaasaja teaduses on, et
meie DNA, genoom, vastab dünaamiliselt keskkonnale.
Stress, dieet, käitumine, toksiinid ja teised faktorid
aktiveerivad kemikaalid või lülitid, mis lülitavad meie geenid sisse või
välja.
Toitumine on üks
kergemaid keskkondlike faktoreid teadusuuringuteks, mis annab üsna
käegakatsutavaid tulemusi. Üks huvitavamaid näiteid toitumise ja geneetika
muutmise kohta viidi läbi Duke Ülioolis 2000 [3].
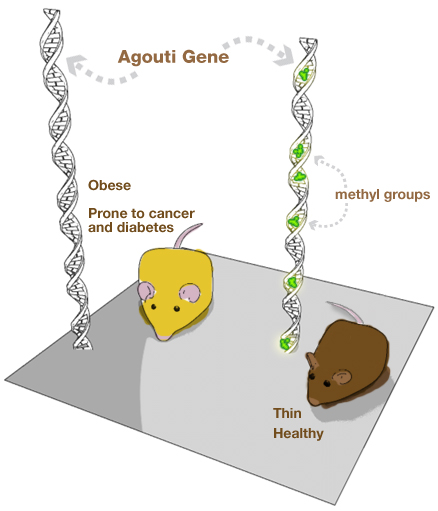
Randy Jirtle ja
doktorikraadi üliõpilane Robert Waterland võtsid paari ülekaalulisi kollaseid
hiiri, kes kandsid agouti geeni – seda geeni on leitud ka inimestelt. See geen
muudab rotid erakordselt näljaseks ja seega viib nad ülekaalu, diabeedi ja
vähini.

Tüüpiline on, et
kui agouti hiir paljuneb, siis järglased on vanematega sarnased – paksud,
kollased ja haigustele vastuvõtlikud.
Selles katses muutsid teadlased lihtsalt emahiirtee
dieeti.
Enne viljastumist
ja raseduse ajal toideti ühte gruppi hiiri toitainerikka (folaadid, B
vitamiinid) dieediga. Need toitaineid on rikkalikult taimses toidus. Teist
gruppi – geneetiliselt identseid hiiri - toideti samal perioodil tavapärase
toiduga, mis oli toitaineliselt vaesem.

Hiir agouti geeniga (Utah Ülikooli pilt)
Teadlaste
imestuseks, sündisid toitainerikka dieediga hiirtel pruunid, saledad, terved
pojad. Samas tavadieedil olnud hiirte pojad olid kollased, paksud ja haigustele
vastuvõtlikud. Ainus erinevus kahel grupil oli
emade dieet.
Metüülgrupid
dieedis, mis sisaldavad foolhappeid, B vitamiine, betaiini, koliini suurendas
hiirtel DNA metüülimist ja hoidis ära agouti geeni väljendumise.
Kemikaalid ja
lisandid, mis sisenevad meie kehasse võivad samuti epigenoomi muuta.
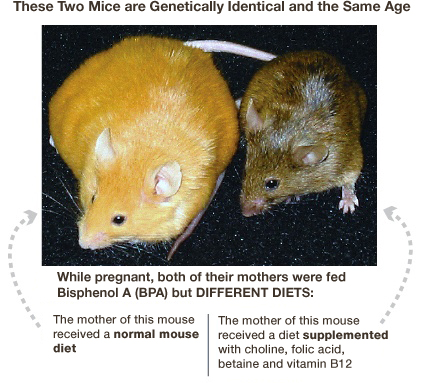
Bisfenool A (BPA) on
aine, mida kasutatakse polükarbonaatplastiku tegemiseks. See sisaldub väga
paljudes tänastes materjalides sh veepudelites ja plekkpurgi voodrites.
Kuid, kui BPAga
kokkupuutunud rasedat kollast hiirt toideti toitainerikka dieediga, mis
sisaldas B vitamiine, folaate,koliini, betaiini, siis järglased olid valdavalt
pruunid Siit nähtub, et peamised toitained võivad kaotada genotoksiliste
kemikaalide mõju [4].

Agouti geeniga hiir, keda toideti Bisfenool A-ga
Ka isa dieet võib
olla oluline!
Rootsis tehtud
uuring 2007 aastal [5] annab tõendid, mis näitavad kui kiire on toitumise efekt
põlvkondade läbilõikes. Vanaisade toitumisplaan mõjutab nende lastelaste
eluiga. Toidu rohkus teisest küljest on seotud lapselaste suuresti lühenenud
elueaga ja see eluiga on lühenenud peamiselt südamehaiguste ja diabeedi
läbi.
See toob meid
võimaluseni, et vanaisa arenguperioodil kirjutasid epigeneetilised mehhanismid
üles toitumisalase info olemasolevast keskkonnast ja see anti edasi järgmisele
generatsioonile.
Ka mesilased
annavad suurepärase näite toitumise võimust geenide üle.
Vastsed, et areneda
kuningannadeks ja töölisteks on geneetiliselt identsed. Vastset, kellest saab
kuninganna, toidetakse mesilasema toitepiimaga.

Nn kuninganna tass,
kus hoitakse toitepiima
Toitepiim on
terviklik, valgurohke aines, mida eritavad töölismesilaste peas olevad näärmed.
Selle toitepiima tarbimine laseb
mesilasel areneda funktsioneerivad munasarjad ja suurema kõhu munade hoidmiseks
– töölismesilane seevastu jääb steriilseks.
Kuningannadel
arenevad ka teatud käitumuslikud erisused, nad on rohkem agressiivsed, otsivad
partnerit ja suhtlevad heli kasutades. Kuningannat toidetakse toitepiimaga kogu
tema elu.
Viimastes uuringute
seerias on teadlased täheldanud, et toitepiim vaigistab võtmegeeni (Dnmt3)[6].
Kui Dnmt3 on aktiivne mesilasvastses, siis kuninganna geenid
epigeneetiliselt vaigistatakse ja vastne areneb tööliseks. Kuid, kui
toitepiim lülitab Dnmt3 välja, siis teatud kindlad geenid hakkavad tegutsema ja
vastsest saab kuninganna.
See oleks ju kõik
väga huvitav, kuid kuidas on see seotud vähiga?
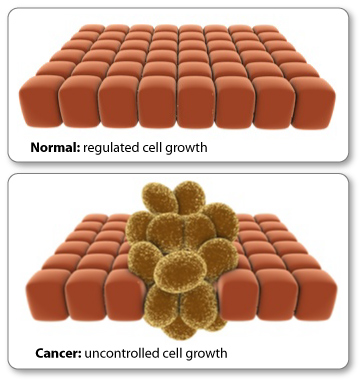
Vähk areneb, kui rakud muutuvad ebanormaalseks ja
hakkava kontrollimatult kasvama.

Normal cells and cancer cells (picture from University of Utah)
Vähk saab alguse,
kui mutatsioon rakus muudab DNA segmenti. Me teame, et mutatsioonid vähemalt
mitmesajas inimgeenis võivad viia ebanormaalse raku kasvuni ja sellise raku
jagunemiseni ning kasvamiseni, mis loob inimehas vähi [7].
Kuid vähirakkudel
on ka ebanormaalne epigenoom.
Paljude vähkide
puhul on mõned geenid sisselülitatud ja mõned välja lülitatud – sageli just
samades rakkudes. Vähk on ainult üks paljudest haigustest, mis on eotud
epigenoomi muutustega.
Mõned vähirakud on
madalama metlülatsiooniga, kui terved rakud.

Liig vähe metüleerimist põhjustab:
Nende geenide aktiveerumise, mis soodustavad raku
kasvu
Kromosoomide ebastabiilsuse – ülikõrge aktiivsusega
DNA, mida on kergem dubleerida, kustutada ja viia teistesse kohtadesse.
Enamiku geenide
puhul pärime me kaks töötavat koopiat – kummagi ühelt vanemalt. Kuid jäljendgeene (imprinted genes) on meil ainult
üks töötav eksemplar. Olenevalt geenist on kas ema või isa geen
epigeneetiliselt vaigistatud. Vaigistamine tavajuhul toimub metüleerimise kaudu
muna- või seemneraku formeerumisel.
Vähirakud võivad ka
omada geene, mis sisaldavad rohkem metüüli ehk on vähem aktiivsed, kui tavajuhul.

Geenitüübid, mis lülitatakse välja vähirakkudes:
Hoia rakkude kasv kontrolli all
parandada kahjustatud DNA
algata programmeeritud raku surm
Kuid siin toimub samuti täielik maagia.
Erinevalt mutatsioonidest, DNA metüülimine ja
histoonide modifitseerimine on pöörduvad.
Teadlased püüavad
ravimiteraapiaga muuta epigeneetilisi profiile vähirakkudes. Üks võimalus
epigeneetika teraapias on välja uurida, kuidas ravim viia õige raku ja õige
koeni.
Näiteks on võimalik
reaktiveerida seisvate kasvaja-supresor geene ravimitega, mis eemaldavad
metüülgrupi histooni valkudest [8].
DNA demetüleerivad
ravimid väikestes kogustes on näidanud kliiniliselt aktiivsust mõnede kasvajate
vastu, näit. leukeemia puhul, kuid siiani ei ole toimet tahkete kasvajate vastu [9].
Võtmeprobleemiks on
see, et need demetüleerivad agendid on mitte-spetsiifilised, sageli toksilised
ja võivad kahjustavalt mõjuda tervetele rakkudel, põhjustades nii uued
mutatsioonid ning kasvajate tekke.
Teised ravimid, mis epigenoomiga seotud on histooni
deatsetülaas (HDAC) inhibiitorid.
Need võivad
sisaldada diferentseerimist, raku-tsükli peatamist ja programmeeritud raku
surma (seda isoleerituna katseklaasis), kuid ei ole võimalik välja tuua nende
mehhanismi, mis selgitaks nende mõju [10].
Kliinilistes
katsetes, HDAC inhibiitoreid seostatakse madala kõrvaltoimete
esinemissagedusega. Esimene seda tüüpi ravim suberoüülaniliid hüdroksaamhape
(vorinostaat) on heaks kiidetud USA Food and Drug Administration (Toidu ja
Ravimiamet) poolt naha T-rakulise lümfoomi raviks [11]. HDAC inhibiitorite
efektiivsus teiste vähiliikide osas on limiteeritud.
Uurimused, mis püüavad manipuleerida ravimitega
epigenoomi on minu arvates mõeldud läbikukkumisele nagu ka aastakümneid kestnud
ravimiotsingud genoomi mõjutamiseks.
Seda seetõttu, et
selline terviklik bioloogiline süsteem nagu inimkeha opereerib väga suurt hulka
omavahel seotud väga keerulisi reaktsioone. Kehas on palju erinevaid nö
päästesüsteeme juhuks, kui üks neist läbi kukub.
Toitumine,
epigeneetika ja vähk


Täiendavalt ravimiuuringutele on olemas
tähelepanuväärne huvi ses osas, kuidas toitained mõjutavad epigenoomi vähi
korral [12] [13] [14] [15].
Ulatuslik ülevaade
kõrge kvaliteediga teadusuuringutest ja dokumentidest, mille kogus kokku ja
vaatas läbi rahvusvaheliste ekspertide meeskond
(World Cancer Research Fund) viis järelduseni, et vähemalt 30-40 %
vähkidest saab vältida oma toitumiskava muutes [16].
Paljud bioaktiivsed
komponendid, mida on leitud toidust on vähivastase toimega, kaitsega vähi vastu
erinevates vähi staadiumites. Dieet omab palju mõjureid kantserogeensuse,
apoptoosise, raku tsükli kontrollimise, diferentseerimise, põletike,
angiogeneesise, DNA parandamise, kantserogeenide ainevahetuse juures [12].
Needsamad protsessid reguleerivad ka DNA metüleerimist ja teisi epigeneetilisi
protsesse.
Suur hulk epidemioloogilisi ja kliinilisi uuringuid
soovitavad tarbida toitu, mis on rikas folaatide osas, mis omakorda on seotud
pärasoolevähi vähenemisega [17].
Alkoholi tarbimine
suurendab naistel rinnavähiriski 41% (kui päevas tarbitakse 30-60 g) võrreldes
alkoholi mittetarbivate naistega [18]. Alkoholi tarbimine on näidanud
folaatide metabolismi põrssimist ja vähiriski suurenemist [19] [20].

Tsingi ja seleeni defitsiit,
A vitamiini liig on seotud DNA hüpometülatsiooniga rottide maksas, samas kui C
vitamiin näiteks selle protsessi kopsu vähirakkudes peatab [12].
On väga palju
sarnaseid näiteid, kuid need vähesed illustreerivad fakti, et paljud
toitumuslikud aspektid on terviklikul ja dünaamilisel moel koostoimes
epigenoomiga, mis mõjutab geene meie tervisele positiivsel moel.
Samas individuaalsete
toitainete uurimine epigeneetilises protsessis ei ole olulisi tulemusi andev,
kuna on liigselt lihtsustatud. Toit sisaldab ääretult palju erinevait
toitaineid ja teisi substantse, mis kõik töötavad omavahel koos orkestrina, mis
kas loob tervist või haigust.

Professor T. Colin
Campbell’i mõtlemist ergutav raamat “The China
Study” tõi laia lugejaskonna teaduskirjandusse, mis puudutab toitumise
mõjusid tervisele. Campbell
selgitab tõenditele toetudes, et taimedel põhinev toitumine on kõige
tervislikum viis süüa ning samal ajal
oluliselt vähendada riski kroonilistesse haigustesse (artriidid, diabeet,
südamehaigused ja paljud vähiliigid) haigestumisel.
Toitumise
selline efekt tuleneb tarbides tervet müriaadi erinevaid kasulikke toitaineid,
mida on leitud taimsest toidust, mis on vastastikku koostoimiv epigenoomiga –
kontrollides nii, et meie geenid lülitatakse korrektselt sisse ja välja.
Colin Campbell jätkab
sama teemat oma uues raamatus “Whole: Rethinking the Science of Nutrition”, mis ilmus mais 2013.
Ka on kasvavas joones kirjutatud ja avaldatud
teaduslikel uuringutel põhinevaid raamatuid meditsiiniinimeste poolt, kus
kirjeldatakse, kuidas meie mõtted ja tunded otseselt mõjutavad meie geene.

Lissa Rankin MD uus ramat “Mind over Medicine” on suurepärane käsitlus koos mõnede võtmeuuringutega.
David Hamilton PhD on
orgaaniline keemik, kes kasutas oma tööd farmatseutiliste uuringute tarbeks sh
südamehaiguste osas. Ta jättis oma töö, kuna huvitus enam platseebo efektist.
David on kirjutanud raamatu “Mõte on see mis loeb”.
Bruce Lipton PhD, rakubioloog ja Wisconsin ülikooli
Meditsiinikooli anatoomiaprofessori raamat “Uskumused ja bioloogia”.
Dean Ornish MD, California Ülikooli Meditsiiniprofessor on uurinud ja ravinud
südamehaigusi ja vähki üle 35 aasta ja seda elustiili faktoreid sh dieeti,
mõtteid, sotsiaalset keskkonda, armastust arvestades. Uuringud mida tema ja tema kolleegid on
teinud, on avaldatud ajakirjades in the
Journal of the American Medical Association, The Lancet, Proceedings of the
National Academy of Sciences, Circulation, The New England Journal of Medicine,
the American Journal of Cardiology, The Lancet Oncology ja elsewhere.

Need uuringud ei ole pseudoteaduslikud, vaid kõrge
kvaliteediga, hoolikalt läbimõeldud ja kontrollitud. See on siin ainult jäämäe
tipp.
See
kõik näitab mee, et me ei ole oma geenide alluvuses ega geenide ohvrid.
Geenid võivad anda
meile eelsoodumuse ehk teatud tervislikud tingimused, kuid nende olemasolu ei
ole jäigalt paika pandud.
Meie keskkondlikud
ja elustiili valikud – mõtted, mida me mõtleme, toit ja jook, mida tarbime,
meiefüüsiline aktiivsus, suitsetamine, meie suhted, meie töö, meie stressi
tase, meie suhtumine maasse, kus elame – kõik see kokku mõjutab meie geene ja
loob meie elusaatuse.
Tõsi on ka see, et
me kõik sureme ühel päeval. Võimalik, et siis tasub mõelda, kas meil on olnud
elu või mitte. Niisiis – võta kokku oma jõud, usalda oma instinkte ses osas,
mis sinule võiks olla parim ja ära lase hirmutajatel enda ümber ennast surnuks
hirmutada, nagu see juhtus Angelina Jolie´ga.
Kasutatud
allikad
[1] Jemal, A. et al (2013). Annual Report to the
Nation on the Status of Cancer, 1975–2009, Featuring the Burden and Trends in
Human Papillomavirus (HPV)–Associated Cancers and HPV Vaccination Coverage
Levels. JNCI J Natl Cancer Inst (2013) doi: 10.1093/jnci/djs491 First
published online: January 7, 2013
[2] Watson, J. Oxidants, antioxidants and the
current incurability of metastatic cancers. Open Biol. 2013 3, 120144,
published online 8 January 2013
[3] Waterland RA, Jirtle RL. Transposable elements:
targets for early nutritional effects on epigenetic gene regulation. Mol Cell
Biol 2003;23(15):5293–5300
[4] Dolinoy D.C., Huang D., Jirtle R.L. (2007). Maternal nutrient supplementation counteracts
bisphenol A-induced DNA hypomethylation in early development. PNAS, 104: 13056-13061.
[5] Kaati G., Bygren L.O., Pembrey M., Sjostrom M.
(2007). Transgenerational response to nutrition,
early life circumstances and longevity. European Journal
of Human Genetics, 15: 784-790.
[6] Kucharski R., Maleszka J., Foret S., Maleszka
R. Nutritional Control of Reproductive
Status in Honeybees via DNA Methylation (2008). Science, 319: 1827-1830 (registration required).
[7] Jones S, Vogelstein B, Velculescu VE, Kinzler KW. 2008 Core signaling
pathways in human pancreatic cancers revealed by global genomic analyses. Science 321, 1801. (doi:10.1126/science.1164368)
[8] Esteller, M. Epigenetics in cancer. N
Engl J Med 2008;358:1148-59.
[9] Mack GS. Epigenetic cancer therapy makes
headway. J Natl Cancer Inst 2006; 98:1443-4.
[10] Bolden JE, Peart MJ, Johnstone RW.Anticancer
activities of histone deacetylase inhibitors. Nat Rev Drug Discov
2006;5:769-84.
[11] Marks PA, Breslow R. Dimethyl sulfoxide to
vorinostat: development of this histone deacetylase inhibitor as an anticancer
drug. Nat Biotechnol 2007;25:84-90.
[12] Davis, C.D and Uthus, E.O. DNA Methylation,
Cancer Susceptibility and Nutrient Interactions. Exp Biol Med November
2004 vol. 229 no. 10, 988-995
[13] Khan, S.I. et al (2012). Epigenetic Events
Associated with Breast Cancer and Their Prevention by Dietary Components
Targeting the Epigenome. Chem. Res. Toxicol. 2012, 25, 61–73
[14] Liu, L. Et al. Aging, cancer and nutrition: the
DNA methylation connection. Mechanisms of Ageing and Development Volume 124, Issues 10–12, December 2003, Pages 989–998
[15] Su, L.J. et al. Epigenetic contributions to
the relationship between cancer and dietary intake of nutrients, bioactive food
components, and environmental toxicants. Frontiers in Genetics, Vol 2, Article
91, 1-12,, 09 January 2012 | doi: 10.3389/fgene.2011.00091
[16] World Cancer Research Organisation. 2nd Expert
Report: Food, Nutrition, Physical Activity and the Prevention of Cancer: A
Global Perspective. Washington DC: AICR, 2007.http://www.dietandcancerreport.org/expert_report/report_contents/index.php
[17] Kim Y.-I. Folate and DNA methylation:
a mechanistic link between folate deficiency and colorectal cancer? Cancer
Epidemiol Biomarkers Prev 13:511–519, 2004.
[18] Smith-Warner, S.A. et al. Alcohol and
breast cancer in women. A pooled analysis of cohort studies. JAMA
279 (1998), 535-540.
[19] van Engeland M, Weijenberg MP, Roemen GM, Brink
M, de Bruine AP, Goldbohm RA, van den Brandt PA, Baylin SB, de Goeij AF, Herman
JG. Effects of dietary folate and alcohol intake on promoter methylation in
sporadic colorectal cancer: the Netherlands cohort study on diet and cancer.
Cancer Res 63:3133–3137, 2003
[20] Choi SW, Stickel F, Baik HW, Kim YI, Seitz HK,
Mason JB. Chronic alcohol consumption induces genomic but not p53-specific DNA
hypomethylation in rat colon. J Nutr 129:1945–1950, 1999.
[21] Ross SA, Dwyer J, Umar A et al. (2008) Diet,
epigenetic events and cancer prevention. Nutr Rev 66 (Suppl. 1), S1–S6.
[22] Fang MZ, Wang Y, Ai N, Hou Z, Sun Y, Lu H, Welsh
W, Yang CS. Tea polyphenol (-)-epigallocatechin-3-gallate inhibits DNA
methyltransferase and reactivates methylation-silenced genes in cancer
celllines. Cancer Res 63:7563–7570, 2003.
[23] Meeran, S. M., Ahmed, A., and Tollefsbol, T. O. (2010)
Epigenetic targets of bioactive dietary components for cancer prevention and
therapy. Clin. Epigenetics 1, 101–116.
[24] Lee, W. J., and Zhu, B. T. (2006) Inhibition of
DNA methylation by caffeic acid and chlorogenic acid, two common
catechol-containing coffee polyphenols. Carcinogenesis 27, 269–277.

Kommentaare ei ole:
Postita kommentaar